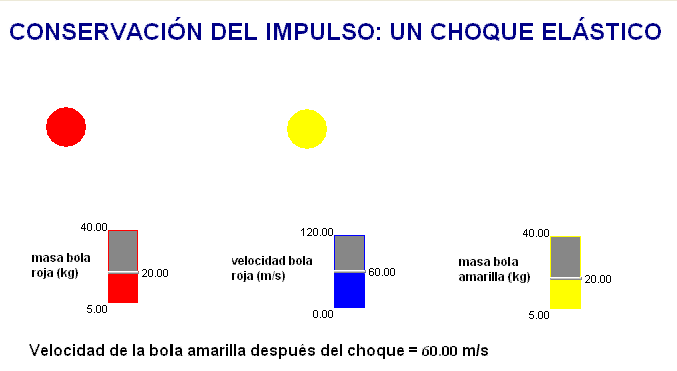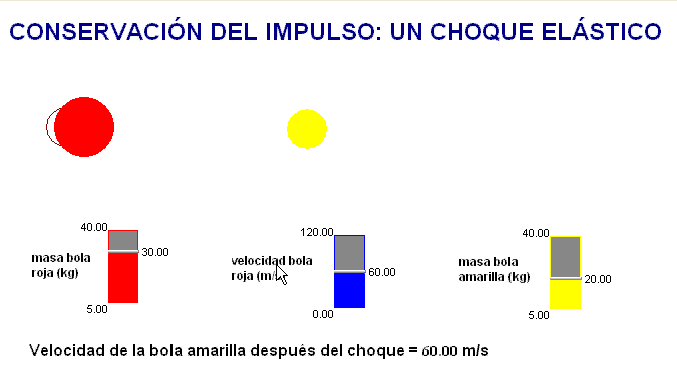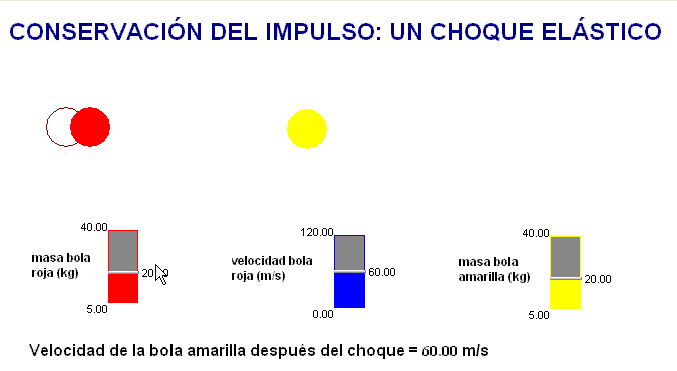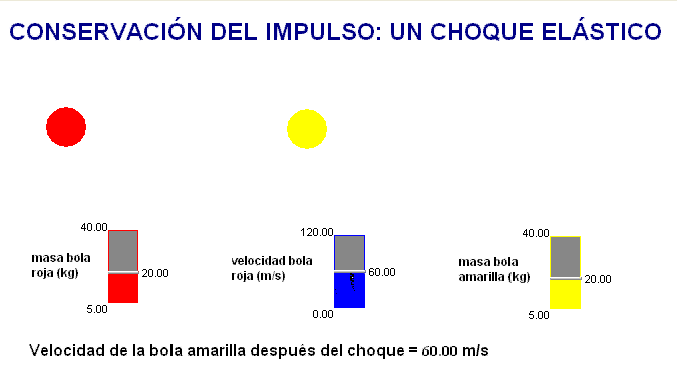
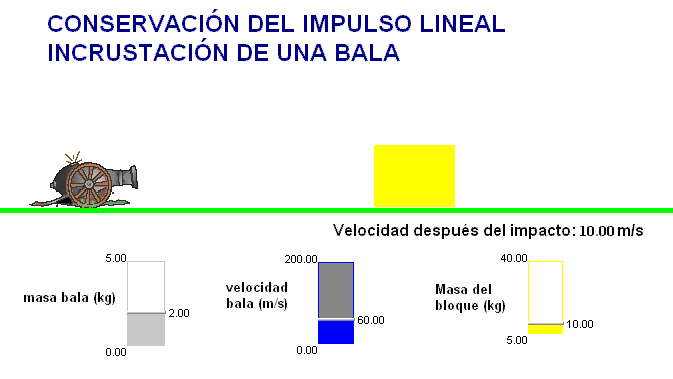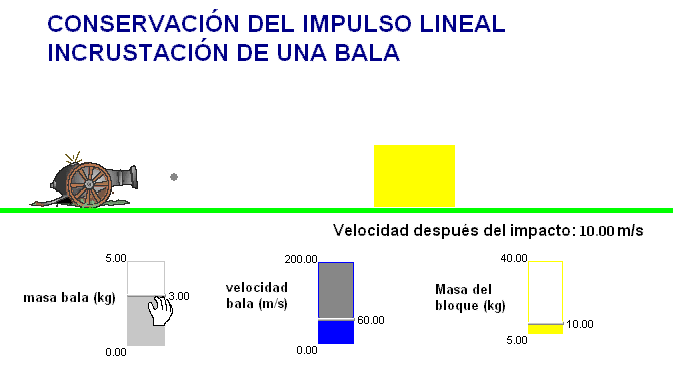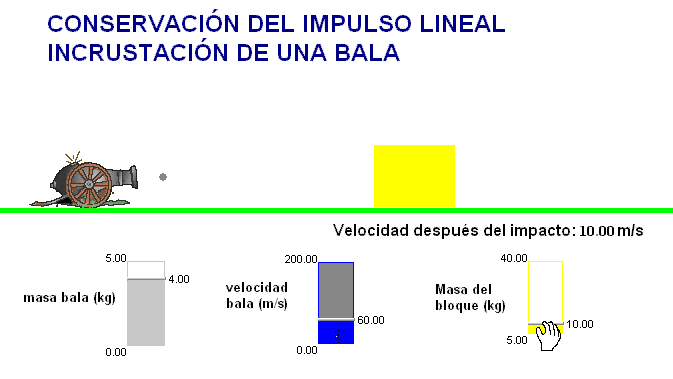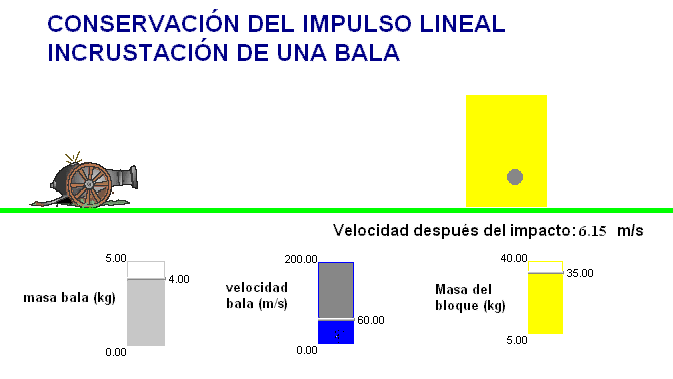
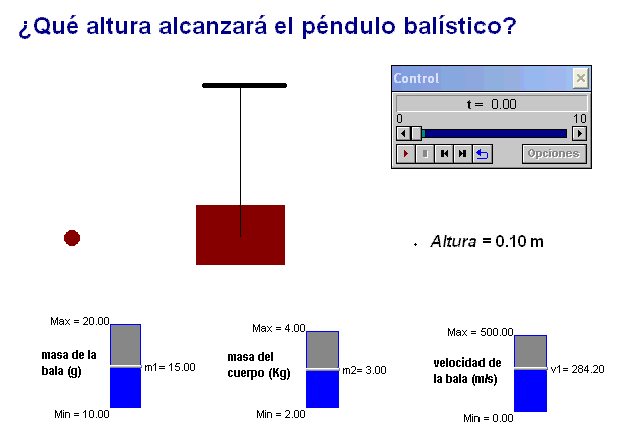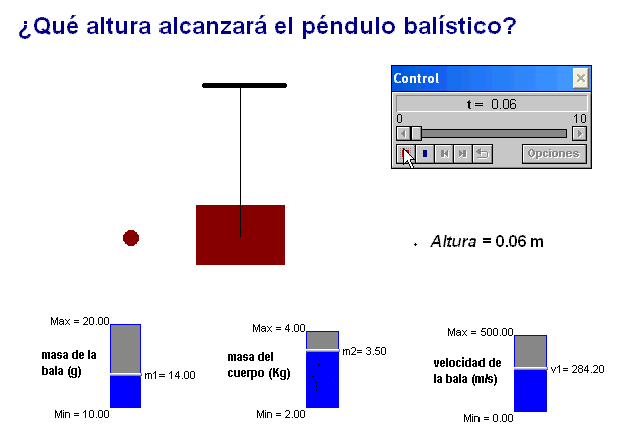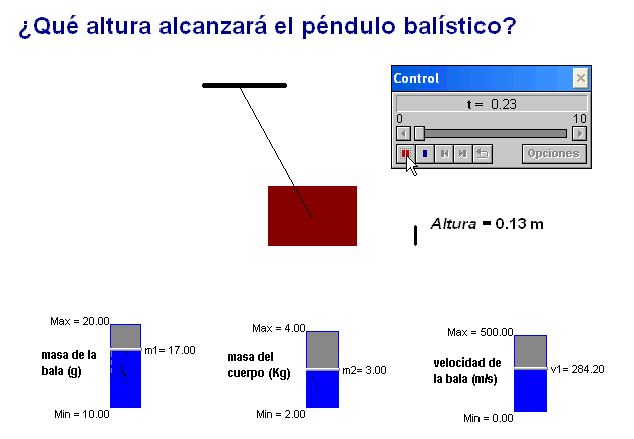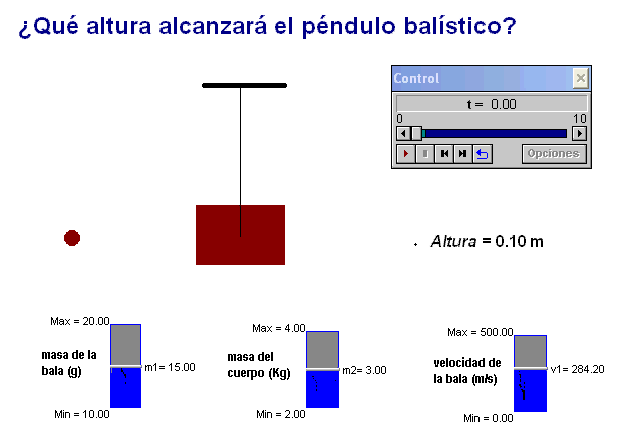
Como profesor siempre he deseado que mis alumnos tuviesen todas las ayudas posibles. Por ello en mis exámenes, he tratado de adaptar situaciones problemáticas o escenarios similares a los trabajados con ellos en clase.
Con objeto de acercar aún más este deseo, en los últimos cursos compartí con ellos no sólo los enunciados de los exámenes, sino también su solución desarrollada.
Estos exámenes resueltos resultaron muy útiles a mis alumnos, especialmente en las sesiones previas a la fecha de cada una de las pruebas. Solucionar en clase los exámenes de otros años, se convirtió en una oportunidad muy útil para ellos, ya que entrenaban sus aciertos y aprendían de sus errores cuando se solucionan en clase sus dudas.
Para bajarlos, sólo haz clic en el enlace o en la imagen. Por supuesto tienes que tener Google Drive.