La volatilidad mide la tendencia de un líquido de pasar a la fase vapor, es decir, de evaporarse hasta intentar alcanzar el equilibrio entre el vapor y la superficie libre del líquido.
A una temperatura determinada, un líquido alcanza su presión de vapor cuando el nº de moléculas de líquido que pasan a la fase gaseosa (L-->G) , coincide con el nº de moléculas de vapor o gas que pasan a la fase líquida (G-->L).
Si el nº de moléculas participantes en este equilibrio es grande, la presión de vapor será alta. Observa que la volatilidad está relacionada con el valor de la presión de vapor.
1. ¿Cuándo se alcanzará el equilibro vapor-líquido?
- Sólo cuando el recipiente sea cerrado, transcurrido un tiempo, tendremos este equilibrio dinámico entre L<-->V.
- Si el recipiente es abierto, nunca se llega a alcanzar el equilibrio y transcurrido cierto tiempo, el líquido se evaporará del todo.
2. ¿Qué líquido es más volátil a una temperatura determinada?
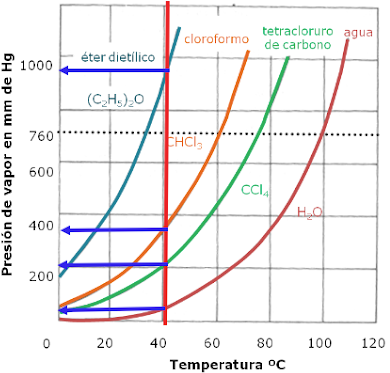
Para razonarlo, usaremos esta gráfica de presión de vapor-temperatura para diferentes líquidos. En ella están señaladas a la temperatura de 40ºC las presiones de vapores (en mmHg). Las presiones de vapor de estos líquidos, a 40ºC están ordenadas así:
- Éter dietílico > cloroformo > tetracloruro de carbono > agua
Por lo que esta será también el orden de sus volatilidades: Aquel que a una temperatura determinada tiene mayor presión de vapor, será más volátil.
3. ¿Qué líquido tiene mayor punto de ebullición?
Un líquido entra en ebullición cuando su presión de vapor alcanza a la presión atmosférica (760 mmHg). Observa en la gráfica cómo cada líquido tiene un punto de ebullición cuando fijamos la presión atmosférica en 1 atm=760 mmHg.
Como puedes observar, el éter dietílico hierve a 35ºC aproximadamente, cloroformo a 60ºC, tetracloruro de carbono a 77ºC aproximadamente, y agua a 100ºC.
Observa que guardan el mismo orden. Los líquidos más volátiles tienen un menor punto de ebullición.
4. ¿Y qué efecto tiene la presión exterior en el punto de ebullición?
Ahora nos vamos a fijar en el agua. Observa cómo:
- A 200 mmHg ( 3,8 veces menos presión que la presión atmosférica), el agua hierve a unos 65ºC. (Fundamento del experimento del agua templada que hierve dentro de una jeringuilla).
- A 760 mmHg = 1 atm, el agua hierve a 100ºC
- A una presión superior, por ejemplo 1000 mmHg (1,3 veces mayor) el agua hierve a 114ºC. (Fundamento de las ollas a presión super-rápidas)






No hay comentarios:
Publicar un comentario