- No tener claros algunos conceptos
- Desconocer el orden en que tienen que intervenir dichos conceptos
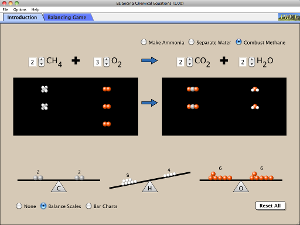
1. La ecuación química ha de estar AJUSTADA.
2. Las cantidades que intervienen en la reacción química son PURAS. Para conocer las cantidades puras que intervienen he de tener en cuenta:
- En un mineral, la riqueza en el reactivo: óxido, metal, etc.
- En una disolución, la concentración en cualquiera de sus formas, nos dirá qué cantidad de soluto intervendrá.
- En una mezcla de gases, el % en volumen del reactivo
4. Para saber por dónde comenzamos a realizar cálculos, hemos de reconocer quién es el REACTIVO EN EXCESO (sobrará cuando finalice la reacción) y quién es el REACTIVO LIMITANTE (cuando se acaba este reactivo, la reacción finaliza).
5. Realizamos los cálculos estequiométricos (con la ecuación química) A PARTIR DE LOS MOLES DEL REACTIVO LIMITANTE.
6. Convertimos los productos o reactivos obtenidos a las canidades impuras en que estén contenidos.
Gracias al Dr. John Pollard y colaboradores por sus animaciones

Click to Run

| Click to Run |

No hay comentarios:
Publicar un comentario